La réponse simple à cette question :
Depuis que la croûte terrestre s’est solidifiée et que l’eau liquide existe à la surface de la planète, l’eau a dissout des minéraux pendant des milliards d’années. Toute l’eau qui est tombée sur les continents a fini par se retrouver dans les océans. Il y a continuellement de l’eau qui s’évapore des océans et forme les nuages qui, à leur tour, retournent l’eau au sol, laquelle revient progressivement dans les océans en dissolvant encore des minéraux. C’est ce qu’on appelle « le cycle de l’eau ».
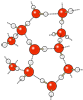
Les substances minérales dissoutes dans l’eau sont sous forme d’ions, c’est-à-dire des éléments ou composés ayant une charge électrique : les cations ont une charge positive, car ils ont donné un ou plusieurs électrons, alors que les anions ont une charge négative, ayant accepté ces électrons. Lorsque les cations et les anions sont liés, on dit que ce sont des sels. Le NaCl, par exemple est le principal constituant du « sel de table ». Le tableau suivant montre la composition typique des océans, laquelle est illustrée par le diagramme juste après.
| Cation | Symbole | Concentration g/kg | Anion | Symbole | Concentration g/kg |
| Sodium | Na+ | 10,8 | Chlorure | Cl– | 19,4 |
| Magnésium | Mg++ | 1,28 | Sulfate | SO4— | 2,71 |
| Calcium | Ca++ | 0,41 | Hydrogéno- | HCO3– | 0,11 |
| Potassium | K+ | 0,40 | carbonate |

Image: Alfred Wegener Institute for Polar and Marine Research, Bremerhaven, GermanySA 3.0, https://commons.wikimedia.org/wiki/File:Sea_salt-e_hg.svg
La réponse compliquée :
Avec ce lessivage des roches pendant une grande période, on pourrait s’attendre à une augmentation de la salinité des océans. Mais il n’en n’est rien : depuis au moins 450 millions d’années, la composition des océans n’a pas changé. C’est là que la réponse devient moins simple. Pour bien comprendre, il faut commencer par le début de l’histoire.
Il y a plus de 4 milliards d’années, la Terre était une boule de matière en fusion, dont les liquides les plus denses se trouvaient plutôt au centre et les plus légers près de la surface. Puis les matières gazeuses, libérées par une intense activité volcanique, se trouvaient tout autour, au-dessus de la surface.
Lorsque la planète s’est refroidie, l’eau a fini par exister à l’état liquide et à dissoudre une partie de ces gaz, ce qui a donné de l’acide chlorhydrique (HCl) et de l’acide sulfurique (H2SO4). Il s’agit de deux acides forts qui ont attaqué les minéraux pour former des chlorures et des sulfates de métaux, dont les plus solubles ont abouti dans les océans.
Mais comme le processus de lessivage des continents est continuel, pourquoi la concentration des sels dans les océans n’augmente plus? En fait, la salinité augmente dans certains lacs salés, comme la mer Morte au Proche-Orient. La mer Morte contient 275 g/kg de sel, comparativement à 35 g/kg pour les océans. Dans ce cas, il s’agit d’un lac situé au-dessous du niveau de la mer, alors que le fleuve Jourdain qui l’alimente lui apporte 850 000 tonnes de sel par an, cette eau est stagnante. Alors, l’eau s’enrichit progressivement en sels. Mais cela ne se passe pas ainsi pour les océans. Les apports de sels sont en équilibre avec les pertes :
- Les ions potassium sont absorbés par les argiles qui sont abondants au fond des océans;
- Les ions calcium sont utilisés par des organismes marins, avant de former des sédiments calcaires;
- Les ions sodium et magnésium se combinent aux roches océaniques contenant de l’olivine (silicate de magnésium et fer) et du pyroxène (silicate de sodium, calcium et magnésium).
On peut aussi se poser la question suivante : pourquoi retrouve-t-on si peu de silicium, d’aluminium et de fer dans l’eau de mer, alors que ce sont les principaux constituants de la croûte océanique comme le montre le tableau suivant:
| Métaux exprimés sous forme d’oxydes dans la croûte océanique | Teneur massique (%) |
| Silice (SiO2) | 50,5 |
| Alumine (Al2O3) | 15,3 |
| Chaux (CaO) | 11,3 |
| Oxydes de fer (FeO et Fe2O3) | 10,4 |
| Oxyde de magnésium (MgO) | 7,6 |
| Oxyde de sodium (Na2O) | 2,7 |
En effet, quand on regarde le tableau suivant, il est clair qu’ils sont en très faibles concentrations dans l’eau des océans :
| Cation | Symbole | Concentration mg/kg |
| Silicium | Si | 0,23 |
| Aluminium | Al | 0,0033 |
| Fer | Fe | 0,00015 |
Notons que les valeurs sont ici en millièmes de gramme par kilo, alors que les sels dans l’eau de mer mentionnés plus haut étaient en g/kg. La raison de ces faibles concentrations est due au fait qu’au pH légèrement alcalin (pH 8) de l’eau de mer, ces métaux sont très peu solubles. S’ils ont pu être dissous lorsque les océans contenaient de l’acide chlorhydrique et de l’acide sulfurique, ils ont précipité il y a longtemps lorsque les acides ont été consommés pour dissoudre les minéraux de sodium, calcium, magnésium et potassium.
Une dernière question : Pourquoi l’eau de mer n’est pas potable?
Il est bien connu qu’une personne sur un radeau au milieu de l’océan peut mourir de soif. En fait l’eau de mer contient environ 35 fois plus de sel que l’eau potable. On sait que dans notre sang et notre urine, le taux de chlorure de sodium est d’environ 0,9 % alors qu’il est de 3,5 % dans les océans. Si on boit de l’eau de mer, ce sel excédentaire devra utiliser l’eau provenant de nos cellules pour être éliminé sous forme d’urine par les reins. Les cellules finiront par mourir de déshydratation, entraînant ultimement la mort de tout l’organisme …
Bertrand Dubreuil, 31 décembre 2020